В настоящее время для остановки кровотечения из варикозно-расширенных вен пищевода и желудка (ВРВСШ) используют средства хирургического, рентген-эндоваскулярного, эндоскопического и медикаментозного гемостаза [5, 6]. Известно, что рентген-эндоваскулярные и эндоскопические технологии позволяют получить недолгий гемостатический эффект. Использование хирургических методов, среди которых базовыми являются операции деваскуляризации и порто-системного шунтирования [5], сопровождаются высокой послеоперационной летальностью [1-4, 7].
Хирургическая травма при открытом (лапаротомия, торакотомия) доступе иногда более значима, по сравнению с травмой, нанесенной непосредственно во время основного этапа операции, особенно это касается больных циррозом печени (ЦП), подавляющее большинство которых поступает в стационар в стадии суб- и декомпенсации .
На наш взгляд, внедрение лапароскопических технологий, благодаря использованию миниинвазивных доступов, принципиально новых методов гемостаза, современных сшиваючих аппаратов значительно розширело показания и возможности выполнения оперативных вмешательств у этой категории больных.
цель исследования
Целью исследования является улучшение непосредственных и отдаленных результатов хирургического лечения больных ЦП с осложнениями портальной гипертензии путем определения возможностей миниинвазивных лапароскопических вмешательств и уточнение показаний к ним и их комбинаций.
Материал и методы
Нами проанализированы клинический материал и результаты лечения 47 больных ЦП, поступивших в клинику в ургентном порядке по поводу острого кровотечения из ВРВСШ в сочетании с другими осложнениями портальной гипертензии (ПГ) и, которым проводилось лапароскопическое оперативное лечение за период 2007-20011 годы. Возраст пациентов колебался от 16 до 70 лет (48 ± 12,8). Подавляющее большинство составляли больные трудоспособного возраста, которые представляли более 57%, что придает этой проблеме социально-экономическое значение.
Этиологическая структура ЦП была следующая: у 23 (49%) пациентов имела место вирусная природа заболевания. Алкогольный гепатит стал причиной ЦБ в 19 (40,4%) больных, у 2 (4,25%) больных развитие заболевания было обусловлено токсическим воздействием вредных веществ, связанных с профессиональной деятельностью, в 2 (4,25%) - аутоиммунных гепатит, в 1 (2,1%) больного - криптогенная этиология заболевания.
По степени печеночной недостаточности (Child-Pugh) больные были распределены следующим образом: в стадии компенсации было 2 (4,2%) больных, в стадии субкомпенсации - 18 (38,2%) больных, в стадии декомпенсации находилось 27 (57,4 %) больных.
В стационаре впервые диагноз ЦБ установлен в 11 (23,4%) больных, куда они попали с клиникой кровотечения из ВРВСШ. Рецидивы кровотечения (ЖК) с ВРВСШ наблюдались у 28 (59,5%) больных; из них один ЖК отмечали у 15 (31,9%), 2 и более ЖК - у 13 (27,6%) больных.
У большинства пациентов, кроме кровотечения из ВРВСШ обнаружили другие осложнения ПГ. Так, в 45 (95,7%) больных на момент поступления в стационар отмечен отечно-асцитический синдром, при этом у большинства больных асцит от транзиторного к напряженному, значительно увеличился в постгеморрагических периоде. Правосторонний плеврит выявлено у 3 (6,3%) больных. В 45 (95,7%) больных выявлена спленомегалия, проявления вторичного гиперспленизму разной степени тяжести: от умеренных (при количестве тромбоцитов 150-100 г / л, лейкоцитов 3-4 г / л) до выраженных (при количестве тромбоцитов <100 г / л, лейкоцитов <2 г / л) выявлены у 43 (91,4%) больных. В 4 (8,5%) больных наблюдалась критическая цитопения с количеством тромбоцитов 30-40 г / л, а лейкоцитов менее 2 г / л. При этом количество эритроцитов не учитывалась, ведь все больные поступили в клинику с кровотечением разной степени тяжести, и анемия была связана прежде всего с острой кровопотерей. В 35 (74,5%) больных были обнаружены проявления портосистемной энцефалопатии от латентной к выраженной клинической формы.
Результаты и обсуждение
Результаты даже миниинвазивного лапароскопического оперативного лечения больных ЦП с кровотечением из ВРВСШ и другими осложнениями ПГ во многом зависят от качества адекватной патогенетически обоснованной предоперационной подготовки.
Комплексная консервативная предоперационная подготовка начиналась с первых часов поступления больного в стационар и была направлена на остановку кровотечения из ВРВСШ, стабилизацию функционального состояния печени, коррекцию нарушений в системе гемостаза, белково-электролитных нарушений, уменьшение интоксикации, гипоксии и предусматривала следующие шаги:
1. При поступлении больных с предварительным диагнозом кровотечение из ВРВСШ и признаками геморрагического шока немедленно начинаем интенсивную терапию в условиях противошоковой палаты, которая предусматривает катетеризацию центральной вены, начало проведения инфузионной терапии с целью пополнения ОЦК.
2. В условиях реанимационного отделения проводим эндоскопическую верификацию источника, которая предусматривает исключение других возможных источников кровотечения (пищевод, кардия, дно желудка, эктопические вариксы) и стигмат недавней кровотечения, оценку факторов риска РК (степень ВРВ, «красные маркеры»). При наличии продолжающейся кровотечения из ВРВСШ на момент эндоскопического осмотра, диагностический этап переходил в лечебный (склеротерапия, клипированием ВРВ). При невозможности достичь гемостаз эндоскопическим путем, а также при наличии угроз возникновения РК (нестабильный гемостаз, красные маркеры) устанавливаем зонд Блэкмора (максимально на 48-72 часа, периодически опуская манжетки на 2-3 часа ежесуточно), проведенного у 11 больных.
3. Учитывая, что после успешного достижения гемостаза и окончания компрессии частота РК, по нашим данным, достигала 36,4% (4 из 11) больных. Поэтому, учитывая столь значительный процент возникновения РК, в дальнейшем пытались оперировать больных в условиях неустойчивого гемостаза в течение 72 часов от поступления в больницу. В операционную подаем таких больных с установленным зондом Блэкмора.
Кроме местного воздействия зонда Блэкмора, направляем лечебную тактику на снижение портального давления, что может быть достигнуто путем снижения системного артериального давления, висцеральной вазоконстрикции, дилятация вен воротной системы и снижением внутришньосудинного печеночного сопротивления. Использование вазоактивных препаратов (глипресин или соматостатин) при остром кровотечении назначаем в течение 2-5 суток. Сандостатин вводим по 25-50 мкг, затем по 25-50 мкг / ч путем в / в инфузии до остановки кровотечения.
Глипресин вводим (сначала 1-2 мг в / в медленно, затем поддерживающую дозу, которая составляет 1 мг каждые 4-6 часов, при необходимости лечение продолжаем 2-3 дня.
4. В раннем постгеморрагических периоде на этапе стабилизации гемодинамики, при которой неизбежно повышение портального давления вследствие массивной инфузионной терапии, с целью профилактики РК и подготовки к оперативному вмешательству используем программируемую гипотензии, которая предусматривает введение b-блокаторов (атенолол, метапролол) самостоятельно или в сочетании с нитратами. B-адреноблокаторы назначаем в такой дозе, которая обеспечивает снижение пульса в покое на 25% от исходного уровня или до 55 ударов в минуту. При бради- и нормакардии, а также при наличии противопоказаний к назначению b-адреноблокаторов (хронические обструктивные заболевания легких, сахарный диабет, перемежающаяся кульгота) используем нитраты (изосорбид-5-мононитрат по 30-60 мг в сутки).
5. Коррекция анемии и гипоксии достигается переливанием эритроцитарной массы (предпочтение отдаем отмытых эритроцитов).
6. С целью коррекции нарушений гемостаза вводим свежезамороженную плазму, ингибиторы фибринолиза (аминокапроновая кислота по 100 мл 3 раза в сутки), этамзилат, викасол.
7. антибиотикопрофилактику проводим всем больным с первых времен поступления в стационар, ведь известно, что склонность к бактериальному гипер-роста в кишечнике, нарушение его моторики, увеличенной проницаемости кишечной стенки у этой категории больных часто приводит к бактериальной транслокации и способствует возникновению асцит-перитонит.
Для подавления амониегеннои флоры кишечника назначаем антибиотики широкого спектра действия (преимущество предоставляем фторхиналонам (ципрофлоксацина 1,0-2,0 г / сут), метрид (100 мл 2-3 раза в сутки), рифаксимин, ванкомицин.
8. В целях снижения гипераммониемии и лечения печеночной энцефалопатии, которая была обнаружена почти у 75% больных, обязательным считаем использование очистительных клизм, сорбентов, а также лактулозы, которые освобождают кишечник от крови.
а) для уменьшения поступления аммиака из кишечника используем лактулозу (дюфалак) в виде сиропа по 30 мл 3-4 р / сутки до появления слабительного эффекта (стул 2-3 р / сут).
б) целесообразно назначение препаратов, усиливающих обезвреживание аммиака в печени: орнитин-аспартат (гепа-мерц вводим в дозе 15-25-50 г / сут в / в в 500 мл изотонического раствора глюкозы), орнитин-кетоглутарат (20 г / сутки в 500 мл изотонического раствора в / в капельно), Гепасол А (по 500 мл / сут).
9. гепатопротекция (глутаргин 40% - 5-10 мл в сутки в / в, гептрал по 400 мг в / в, гепадиф 1 флакон в сутки в 5% раствора глюкозы в / в).
10. блокаторы желудочной секреции используем 2 раза в сутки (омепразол 20 мг 2 раза в сутки, омез 40 мг в / в, лансопрозол).
11. Витамины В1 (1 мл в / м в сутки), В6 (1 мл в / м в сутки), Е (200-300 мг в сутки), С (10% -10 мл в 5% растворе глюкозы, в / в ), липоевая кислота1 мл в / м).
12. Коррекция отечно-асцитической синдрома начинаем по ограничению соли в пище (не более 88 ммоль - 5,2 г / сут) потребления жидкости ограничиваем в 750-900 мл / сут. С диуретиков препаратов используем верошпирон как базовый препарат для лечения асцита от 150-400 мг / сут. Для усиления диуретического эффекта назначаем фуросемид 40-80-160 мг в сутки под контролем электролитов крови.
13. Важным моментом лечения отечно-асцитической синдрома является коррекция диспротеинемии, которая достигается введением 10-20% раствора альбумина в количестве - 50-200 мл в / в, свежезамороженной плазмы 400-600 мл / сут.
После остановки кровотечения, стабилизации гемодинамики и показателей гемостаза проводили основной этап лечения - разработанную нами патогенетически направленную оперативную коррекцию гепатоспланхничнои зоны, которая предусматривала проведение лапароскопической и лапароскопически-видеоасистованои редукции селезеночного кровотока и порто-азигального разъединения с транс секцией и фундопликацию пищевода (был прооперирован по данной методике 26 больных) и без транссекции пищевода (был прооперирован по данной методике 21 больной).
Схемы оперативных вмешательств представлены на рисунках 1 и 2.
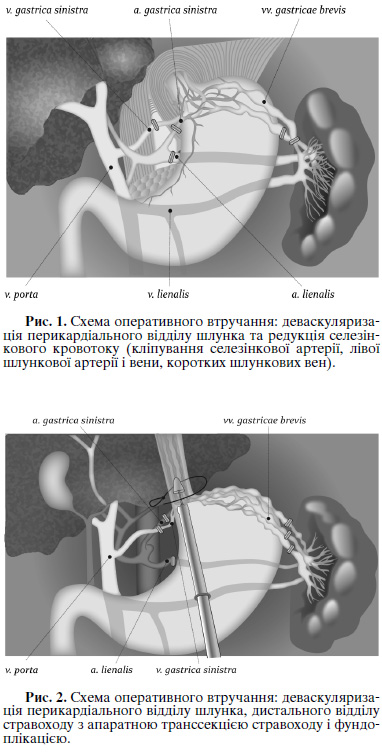
Редукция селезеночного кровотока предусматривала клипирования (лигирование) селезеночной артерии в ее начальной части от брюшного ствола. Этап порто-азигального разъединения в зависимости от объема деваскуляризации предусматривал: деваскуляризацию перикардиальной части желудка (лигирование левой желудочной артерии, левой желудочной вены, клипирования или биполярную коагуляцию коротких желудочных сосудов, лигирование левой желудочно-сальниковой артерии) без (или) в сочетании с деваскуляризациею дистального отдела пищевода с аппаратной циркулярной транссекциею пищевода и фундопликацию по Нисен или Дором. Объем оперативных вмешательств у пролеченных больных представлены в таблице.

Лапароскопическое вмешательство без мануальной асистенции выполнено нами только у 2 (4,2%) больных, что обусловлено, прежде всего, технической сложностью выделения селезеночной артерии у больных с алкогольной этиологии заболевания и у больных с склеротическими изменениями в поджелудочной железе.
Осложнения во время операции возникли у 4 больных. Среди всех осложнений наиболее серьезными считаем кровотечение из a.lienalis, что было связано с наличием выраженного склеротического процесса в поджелудочной железе с привлечением в этот процесс задней стенки селезеночной артерии, при мобилизации которой и возникла массивное кровотечение у 2 больных. При этом у одного больного удалось ликвидировать вышеупомянутое осложнения дополнительным клипированием, а у другого потребовало конверсии и прошивки сосуды проксимальнее места повреждения вместе с окружающими тканями.
Среди других осложнений, у одной больной возникло кровотечение из передней ветви v.gastrica sinistra во время ее выделения, которая была остановлена дополнительным клипированием. В одном случае наблюдался разрыв капсулы селезенки с кровотечением во время разделения спаек между селезенкой и большим сальником, кровотечение было остановлено клипированием селезеночной артерии и биполярной коагуляцией.
Послеоперационные осложнения возникли у 4 (8,4%) больных. Среди осложнений, связанных с редукцией кровотока в бассейне селезеночной артерии у 2 (4,2%) больных, по данным ультразвуковой наблюдали в паренхиме селезенки ишемические аваскулярные ячейки диаметром от 1.0 до 3.0 см без признаков деструкции. Назначение дезагрегантного инфузионной и антибиотикотерапии в течение 10-14 суток способствовало исчезновению клинической картины ишемического инфаркта селезенки у одного больного. Но у другого больного, несмотря на вышеуказанную терапию, в воротах селезенки на контрольном Ультрасонографические исследовании было обнаружен очаг инфаркта с тромбозом селезеночной вены назначения адекватной антикоагулянтной терапии эффекта не дало, после чего наблюдали ухудшение общего состояния больного с прогрессированием печеночной недостаточности, что стало причиной смерти. На секции в воротах селезенки обнаружили инфаркт 2,0х2,3 см.
Послеоперационная летальность составила 4 (8,5%), все умершие больные по состоянию печеночной недостаточности отвечали класса Child-Pugh.
Отдаленные результаты лапароскопических и лапароскопически-асистованих оперативных вмешательств были проанализированы нами в прооперированных больных от 6 месяцев до 5 лет. Средний срок наблюдения составил (34,5 ± 15,3) месяцев. Проанализировав результаты в двух подгруппах в зависимости от объема порто-азигального разъединения (с транссекциею и фундопликацию или без нее) мы пришли к выводу, что у больных, в которых проводилась только лапароскопическая редукция селезеночного кровотока с деваскуляризациею перикардиального отдела желудка без транссекции и фундопликации пищевода, положительный результат по контролю за ЖК наблюдали только у 71,4% больных. При проведении контрольной ФЭГДС на 3-4 недели после оперативного вмешательства степень ВРВ пищевода после операции у этих больных не изменился. Все больные, у которых возник РК имели III степень ВРВ пищевода, кроме того у 4 больных это были рецидивирующие кровотечения.
Считаем РК по ВРВ пищевода возник в связи с недостаточным гипотензивным эффектом в портальной системе, что позволяет сделать вывод о нецелесообразности такого объема вмешательства больным с III степени ВРВ пищевода и больным с рецидивирующими кровотечениями при любой степени ВРВ.
Лучшие результаты мы получили у 26 больных, которым кроме редукции селезеночного кровотока и перикардиальной деваскуляризации данный объем оперативного вмешательства дополнен циркулярной аппаратной транссекциею пищевода и фундопликацию. При проведении контрольной ФЭГДС через 3-4 недели после оперативного вмешательства наблюдали уменьшение степени ВРВ пищевода минимум на 1 ступень, а у 8 больных наблюдали уменьшение ВРВ пищевода с убыванию вен. За период наблюдения в этой группе мы наблюдали один ЖК из ВРВ пищевода, который возник через 3 года после оперативного вмешательства.
Положительную динамику относительно коррекции вторичного гиперспленизму, связанную с редукцией селезеночного кровотока, мы наблюдали в 69,7% больных, что проявлялось увеличением количества тромбоцитов уже на следующий день после операции в 170-320 г / л, но у 5 (11,6 %) больных с критической цитопении (30-40 г / л) и со значительным спленомегалией течение недели наблюдалась тенденция к снижению количества тромбоцитов до субнормальных показателей (90-110 г / л). В дальнейшем у 10 (21,2%) больных, в среднем через 6 месяцев - 1,5 года после оперативного вмешательства, наблюдалась тенденция к увеличению размеров селезенки, с соответствующим уменьшением количества тромбоцитов в субнормального уровня, а у 2 больных наблюдали снижение количества тромбоцитов до 60-70 г / л. Вышеупомянутые изменения объясняем формированием компенсаторного коллатерального кровоснабжения селезенки.
Отечно-асцитический синдром был ликвидирован полностью в 22 (51,1%) больных, а у 17 (39,5%) пациентов значительно уменьшился и корректировался меньшими дозами диуретиков, в 2 (4,6%) случаях остался без изменений, в 2 (4,6%) случаях был прогрессирующим характер, что требовало дальнейшей коррекции. В трех больных после операции исчез правосторонний плеврит, который был резистентным к терапии до операции, что требовало неоднократных плевральных пункций и дренирования плевральной полости по Бюлау (у одного больного).
выводы
1. Предложенные лапароскопические операции у больных, имеющих высокий операционный риск, сопровождаются минимальной кровопотерей, незначительной болевой реакцией, быстрой реабилитацией, что позволяет использовать их не только в стадии компенсации цирроза печени (ст. А Child-Pugh), но и в стадиях суб - и декомпенсации (ст. В и С Child-Pugh).
2. Выбор объема лапароскопических оперативных вмешательств должна зависеть от степени ВРВСШ и наличии РК. Так, деваскуляризация кардии и дна желудка в сочетании с редукцией селезеночного кровотока, эффективная относительно контроля кровотечений и является вполне достаточным объемом оперативного вмешательства у больных с I степенью ВРВСШ, в то время как у больных с II-III степени ВРВСШ контролирует рецидива кровотечений только в 71,4%. Для больных с II-III степени ВРВ, а также больным с рецидивами кровотечений адекватным объемом лапароскопического оперативного вмешательства является сочетание редукции селезеночного кровотока с деваскуляризациею кардии, дна желудка и дистального отдела пищевода с аппаратной циркулярной транссекциею, что способствует полному порто-азигальному разъединению и эффективно контролирует рецидив кровотечения в 96,2% больных.
3. Разработанная лапароскопическая и лапароскопически-асистована коррекция гепатопортального кровотока является патогенетически обоснованным миниинвазивным оперативным вмешательством, которое в дальнейшем не только снижает риск рецидива кровотечения из варикозно-расширенных вен пищевода и желудка, но и положительно влияет на другие осложнения портальной гипертензии, а именно корректирует гиперспленизм , асцит и правосторонний плеврит.
